"미생물 감염 대응에서의 보체 대체 경로의 중요성과 활성화 과정 탐구"
면역학에서 보체(complement)는 체내에서 세포막에 부착된 단백질로서, 면역 시스템의 중요한 부분 중 하나입니다. 보체는 3가지 활성화 경로가 있습니다. 첫번째는 고전적 경로(classical pathway)입니다. 이 경로는 항체에 의해 매개됩니다. 항체가 항원에 결합하면 C1 단백질이 활성화되고, 이어서 다양한 단백질들이 차례로 활성화됩니다. 두번째는 대체경로(Alternative pathway)입니다. 이 경로는 항체가 필요하지 않고 미생물 세포막에 직접적으로 상호작용합니다. 세번째는 렉틴 경로(Lectin pathway) 입니다. 이 경로는 렉틴이라 불리는 단백질이 결합하는 경로로, 일반적으로 세포 표면에 존재하는 당분과 결합합니다.
오늘은 3가지 보체 활성화 경로 중 박테리아 감염 시 가장 먼저 활성화되는 보체 대체경로(alternative pathway)에 대해 자세히 알아보도록 하겠습니다. 이 경로는 항체에 의해 활성화 되지 않고, 직접적인 접촉을 통해 활성화됩니다. 보체 단백질 중 C3는 경로 활성화에서 중요한 역할을 합니다. 대체 경로에서 C3 단백질은 혈장을 자유로이 순환하다가 병원체나 유해물질의 표면에 결합합니다. 이러한 결합은 자연적으로 발생할 수 있거나, 면역반응에 의해 유발될 수 있습니다. C3 단백질이 표면에 부착 이후 다른 보체 단백들도 차례로 활성화되어 혈액 응고, 염증, 세포 독성 등을 촉진합니다.
C3은 간에서 생성되며 이때 티오에스터 결합(Thioester bond)은 단백질 안에 모여 있습니다. C3가 혈장의 수용성 환경으로 분비가 되면 티오에스터 결합이 가수분해 될 수 있도록 단백질의 구조가 변합니다. C3 분자가 병원체, 특히 박테리아와 근접한 환경에서 일부 티오에스터 결합이 가수분해되어 iC3 또는 C3(H20) 형태를 지닙니다. 이 단계가 대체경로의 첫번째 단계입니다. 일부 티오에스터 결합이 가수분해된 iC3는 B 인자와 결합하여 B 인자가 단백질분해효소인 D 인자(세린 단백질분해효소)에 의해 절단되기 쉽게 만듭니다. D 인자에 의해 B 인자가 Ba, Bb 형태의 두 조각으로 절단됩니다. Ba는 혈장을 순환합니다. Bb는 iC3에 결합한 채로 단백질 분해효소의 활성을 지닌 iC3Bb 형태로 존재합니다. 이는 용해성 C3 전환효소라고 부릅니다. 따라서 iC3Bb는 절단되지 않은 iC3 분자와 결합하여 C3a와 C3b 두 조작을 절단합니다. C3b는 병원체 표면에 공유결합 형태로 부착하고 C3a는 자유롭게 혈장을 순환합니다.

병원체와 결합한 C3b는 B인자와 결합하여 D인자로부터 절단되게 합니다. 이 반응으로 Ba의 방출과 Bb는 C3b와 복합체를 만들어 병원체 표면에 결합합니다. 병원체 표면에 결합한 C3bBb는 대체경로에서 작용하는 표면 결합 전환효소로써 대체 C3 전환효소(alternative C3 convertase)라고 부릅니다. 이 효소는 C3를 절단하여 병원체에 결합하는 C3b 조각과 작은 용해성 C3a 조각을 더 많이 생성합니다. 병원체에 결합한 C3b 조각은 대체 C3 전환효소, C3bBb를 더 많이 만드는데 이용되거나 식세포 수용체에 대한 리간드로 이용될 수 있습니다. 작은 용해성 C3a 조각은 식세포를 보체 고정 장소로 유인하는 역할을 합니다.

병원체에 결합하고 있는 대체 C3 전환효소(C3bBb) 한 분자가 부가적으로 더 많은 대체 C3 전환효소(C3bBb)를 생성할 수 있기 때문에 반응이 빠르고 폭발적을 일어납니다. 따라서 두 종류의 보체 조절단백질(complement control protein)이 병원체 표면의 C3b를 안정화 키거나 분해하는 반응을 조절합니다. C3b를 안정화 시키는 보체 조절단백질은 프로퍼딘[properdin, P 인자(factor P)]이고 C3b를 분해하는 보체 조절 단백질은 H 인자(factor H)입니다.
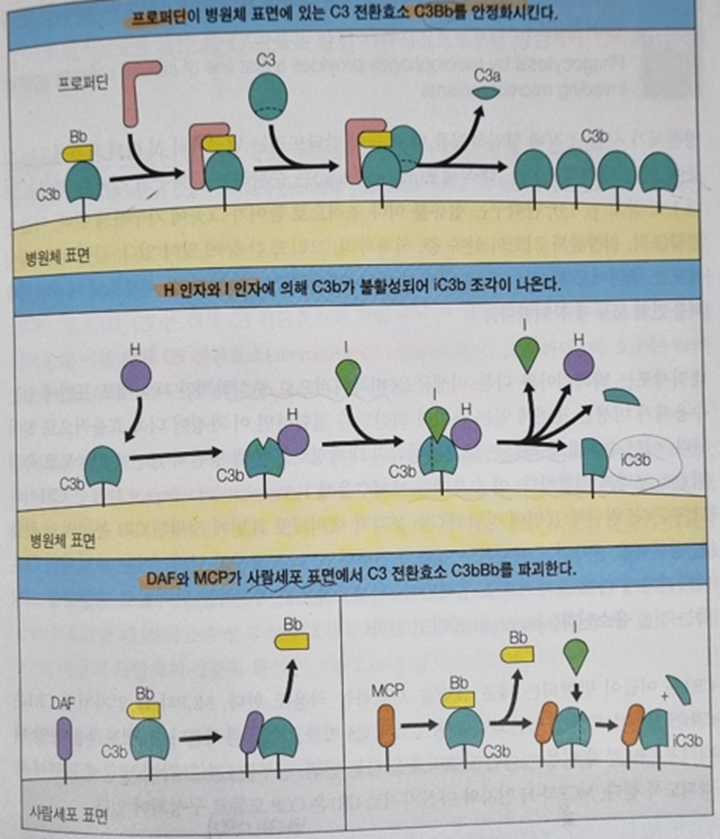
혈장 단백질 프로퍼딘은 병원체 표면에 있는 C3 전환효소 C3bBb와 결합하여 단백질분해효소에 의한 C3bBb의 분해를 방지함으로써 보체 활성의 속도와 강도를 증가시킵니다. 프로퍼딘과 반대 작용을 하는 혈장 단백질은 H 인자로 C3b에 결합하여 I 인자(factor I, 혈장 세린 단백질분해효소)에 의해 iC3b 형태로 만듭니다. 병원체 표면에 결합한 iC3b는 C3 전환효소 C3bBb를 조립할 수 없기 때문에 C3 전환효소의 수를 감소시킵니다.
사람세포 표면에 C3 전환효소 C3bBb가 형성되면 두 가지 막단백질이 작용하여 C3 전환효소 C3bBb를 파괴합니다. 이 두가지 막단백질은 붕괴촉진인자(decay-accelerating factor, DAF)와 막 공동인자 단백질(membrane co-factor protein, MCP) 입니다.
붕괴촉진인자는 대체 C3 전환효소의 C3b 성분과 결합하여 C3b를 떼어내고 불활성화 시킵니다. 막 공동인자 단백질도 이 기능이 있으나, 막 공동인자 단백질에 C3b가 결합하면 I 인자에 의해 절단되고 불활성화 됩니다. 막 공동인자 단백질은 용해성 보체 조절일자인 H 인자의 기능과도 비슷하여 막에 결합할 수도 있습니다. 이 조절단백질은 합동으로 작용하여 보체가 정확하게 병원체 표면에는 많이 고정되고 사람세포 표면에는 적게 고정되도록 합니다. 이런 방법으로 보체계는 사람세포와 미생물 세포를 구분하고 침입하는 병원체를 파괴하고 죽이는 메커니즘을 유도합니다. 면역학에서 이런 형태의 구분은 자기(self)와 비자기(non-self)라고 합니다.
'면역학 쉽게 이해하기' 카테고리의 다른 글
| 면역학 쉽게 이해하기. 내재면역, 적응면역, 그리고 보체의 역할 (0) | 2024.02.05 |
|---|
