
1. 학습목표
면역 시스템의 핵심 구성 요소인 보체 시스템의 작용 메커니즘을 상세히 이해하고, 특히 박테리아 감염 시 내재면역계에서 활성화되는 보체 대체경로의 복잡한 단계 및 이를 조절하는 다양한 단백질들의 기능을 파악해 봅시다.
2. 내용
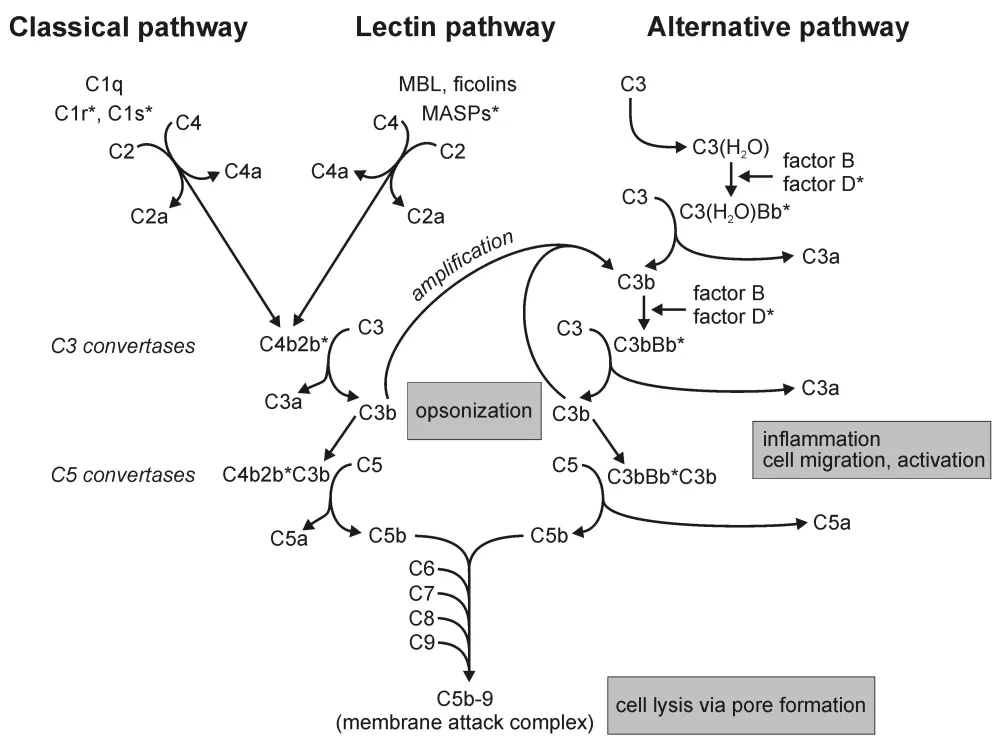
박테리아 감염이 일어났을 때 내재면역계에서 보체 대체경로가 가장 먼저 활성화됩니다. 보체 활성화 대체경로의 첫번째 단계에서 C3가 절단되지 않으면서 Ic3 또는 C3(H2O)라는 형태의 C3분자가 생깁니다. 이 반응은 혈장에서는 자발적으로 쉽게 일어나지 않지만 특정 병원체, 특히 박테리아와 근접한 환경에서는 촉진된다. 또한 고농도의 혈중 C3(약1.2mg/ml)도 자발적 가수분해반응을 촉진합니다.
iC3는 비활성 보체인 B인자(factor B)와 결합하여 B 인자가 D인자(factor D)로부터 절단되기 쉽게 만듭니다. 이 반응으로 방출되는 작은 Ba 조각이 생성되고 단백질 분해 효소 활성이 있는 큰 조각 Bb는 iC3에 결합한 채로 남아 있습니다. iC3Bb 복합체는 절단되지 않은 C3 분자와 결합하여 iC3을 C3a, C3b 조각으로 절단하며, C3b는 병원체와 공유결합으로 결합합니다.
C3를 절단하고 활성화하는 C3 전환효소(C3 convertase)라고 부르는 단백질분해효소인 iC3Bb는 용해성 C3 전환효소의 한 예입니다. iC3와 마찬가지로 병원체에 결합한 C3b는 B 인자와 결합하여 D 인자에 의한 B 인자의 절단을 촉진합니다. 이 반응은 Ba의 방출과 미생물 표면에 C3bBb 복합체의 형성을 유도합니다. C3bBb는 대체 C3 전환효소(alternative C3 convertase)라 불리는 강력한 C3 전환효소로서 병원체 표면에 바로 작용합니다. C3bBb는 C3와 결합하여 티오에스터 결합을 활성화시키면서 C3b와 C3a로 절단합니다. 이 전환효소는 병원체 표면에 놓이기 때문에 iC3Bb처럼 확산될 수 없어 C3b 조각의 많은 부분을 병원체 상에 고정되게 됩니다. 일단 몇몇 C3 전환효소 분자가 조립되면 이들은 더 많은 C3를 절단하고, 더 많은 C3b가 미생물 표면에 고정되어 더 많은 전환효소가 조립되게 합니다. 효소 반응 생성물인 C3b가 더 많은 효소를 조립하는 이러한 양성 되먹임 과정은 C3 절단을 계속하여 증폭하는 한 방법입니다. 처음에 소수의 C3b 분자가 병원체에 부착되면서 병원체는 빠르게 이들 분자로 둘러싸이게 됩니다.
C3 전환 효소인 C3bBb는 많은 부가적인 C3bBb 분자를 생성할 수 있어서 빠르고 폭발적인 반응을 수행할 수 있습니다. 대략적으로 두 종류의 보체 조절 단백질(Complement Control Protein)은 세포 표면에서 주로 C3b를 안정화하거나 분해 반응을 조절하기 위해 진화했습니다. 한 부류는 사람과 미생물 세포 표면에 부착된 C3b와 결합하는 혈장 단백질로 구성되어 있으며, 다른 부류에는 세포 표면에서의 보체 고정을 방지하는 사람 세포의 막 단백질이 포함되어 있습니다.
혈장 단백질 프로퍼딘(Properdin 또는 P 인자)은 미생물 표면에 존재하는 C3 전환효소인 C3bBb와 결합하여 단백질분해효소에 의한 C3bBb의 분해를 방지함으로써 보체 활성의 속도와 강도를 증가시킵니다. 이와는 반대로 작용하는 혈장 단백질인 H 인자(Factor H)는 C3b에 결합하여 혈장 세린 단백질분해효소 I 인자(Factor I)에 의해 C3b가 iC3b라는 형태로 더 절단되도록 촉진합니다. iC3b 조각은 C3 전환효소의 조립을 방해하므로, H와 I 인자의 합동 작용이 병원체 표면에 있는 C3 전환효소의 수를 감소시킵니다. H와 I 인자에 의한 음성 조절의 중요성은 유전적으로 I 인자가 결여된 환자에서 나타나는 면역결핍증으로 확인됩니다. 이러한 환자에서 C3 전환효소인 C3bBb의 형성은 혈액, 세포외액, 림프액에 저장된 C3가 고갈될 때까지 조절되지 않고 발생합니다. I 인자가 결핍된 사람이 박테리아에 감염되면, 비정상적으로 적은 양의 C3b가 박테리아 표면에 고정되어 식세포에 의한 박테리아 제거를 비효율적으로 만듭니다.
두 번째 보체 조절단백질은 사람세포 표면에서 보체 활성을 방해하는 막단백질로 이루어져 있습니다. 붕괴촉진인자(decay-accelerating factor, DAF)는 대체 C3 전환효소의 C3b 성분과 결합하여 C3b를 떼어내고 불활성화 시킵니다. 또한, 막 공동인자 단백질(Membrane Co-factor Protein, MCP)도 비슷한 기능을 하지만, MCP에 C3b가 결합하면 I 인자에 의해 절단되어 불활성화됩니다. MCP의 기능은 용해성 보체 조절인자인 H 인자의 기능과 유사하며, 막에 결합할 수도 있습니다.
H 인자는 사람세포 표면의 탄수화물 성분 중 시알린산(sialic acid)에 특이적으로 결합하는 부위를 가지고 있습니다. 보체 작용을 피하기 위한 전략으로 Streptococcus pyogenes와 Staphylococcus aureus 같은 몇몇 종의 박테리아는 시알린산으로 세포 표면을 덮고 있습니다. 이런 방법으로 박테리아는 사람세포를 흉내 냅니다. 결과적으로 C3b가 이런 박테리아의 표면에 축적될 때 이 C3b는 박테리아의 시알린산에 결합한 H 인자에 의해 즉시 불활성화됩니다.
DAF, MCP, H 인자와 같이 보체를 조절하는 다양한 단백질 중 많은 종류는 보체 조절단백질(complement control protein, CCP) 모듈로 알려진 구조적으로 비슷한 모듈이 여러 개 붙어 만들어진 가늘고 긴 구조입니다. DAF(Delay-Accelerating Factor), MCP(Membrane Co-factor Protein), H 인자와 같은 보체를 조절하는 여러 단백질들은 보체 조절단백질(complement control protein, CCP) 모듈로 알려진 구조적으로 비슷한 모듈이 여러 개 결합하여 만들어진 형태를 가지고 있습니다. 이 구조는 보체 시스템을 효과적으로 조절하며, 이 단백질들이 다양한 기능을 수행할 수 있도록 도와줍니다. 이 모듈 구조는 생물의 면역 체계에서 보체 활성을 조절하고, 다양한 환경에서의 면역 반응에 적응할 수 있도록 해줍니다. 각 모듈은 약 60개의 아미노산으로 구성되어 있으며, 이들은 2개의 보존된 이황화결합으로 안정화된 β-주름판 두 조각으로 이루어진 압축된 샌드위치로 접힙니다. CCP 모듈을 구성하는 단백질은 보체활성 조절인자(regulator of complement activation, RCA)라고도 부릅니다.
C3 활성을 촉진하고 조절하는 반응의 복합 효과는 C3b가 실제로 사람세포가 아닌 병원성 미생물 표면에 축적되도록 합니다. 이런 방법으로 보체계는 사람세포와 미생물 세포를 구분하고 침입하는 병원체를 파괴하고 죽이는 메커니즘을 유도합니다. 면역학에서 이런 형태의 구분을 자기(self)와 비자기(non-self)의 구분이라고 합니다.
3. 요약
내재면역의 보체 대체경로는 박테리아 감염 시 C3를 활성화시키며, 이로부터 파생된 C3b는 병원체에 결합하여 면역 시스템이 병원체를 파괴하는 과정에 핵심 역할을 합니다. 프로퍼딘, H 인자, DAF, MCP 등의 단백질은 보체 활성을 조절하고, C3b의 양성 조절과 음성 조절을 통해 효과적인 면역 반응을 조절합니다.
참고문헌- 면역학 3판, 라이프사이언스
'면역학' 카테고리의 다른 글
| "면역의 감시탑: Toll 유사 수용체의 다양한 미생물 감지와 면역조절" (0) | 2024.01.16 |
|---|---|
| 미생물과의 상호작용, 대식세포의 수용체와 내재면역의 효과적인 대응 (0) | 2024.01.15 |
| 보체 활성화와 면역 체계의 공동 작용, 염증 유도 및 감염 대응 메커니즘 (2) | 2024.01.13 |
| 미생물의 침입을 막아라, 보체가 펼치는 면역 전쟁 (2) | 2024.01.13 |
| 면역의 미스터리, 다양한 병원체와 우리 몸의 방어전략 (2) | 2024.01.13 |



